§ 33. Основы астроспектроскопии
Спектральный анализ - мощнейшее орудие изучения космических объектов.
Прибор для получения спектра - спектроскоп состоит из коллиматора, призмы и зрительной трубы (рис. 73). В передней части коллиматора, обращенной к источнику света, установлена узкая щель. От нее внутрь трубки коллиматора идет расходящийся пучок лучей. Щель располагают в главном фокусе объектива коллиматора, так что из коллиматора выходит параллельный пучок лучей.
Что произойдет, если мы направим этот пучок лучей в объектив третьей составной части спектроскопа - зрительной трубы?
Ее объектив соберет лучи в своем главном фокусе и здесь образуется изображение щели; мы можем его рассматривать в окуляр и увидим четкое изображение входной щели спектроскопа.
Между объективами коллиматора и зрительной трубы помещают трехгранную стеклянную призму таким образом, чтобы ее преломляющее ребро было параллельно щели. Призма преломляет падающий на нее из объектива коллиматора параллельный поток лучей, отклоняя его к своему основанию. При этом лучи различного цвета отклоняются по-разному, в зависимости от длины волны, как это следует из формулы (3.2). Таким образом, призма разлагает свет на совокупность одноцветных (монохроматических) пучков лучей. Вместо одного изображения щели в фокальной плоскости зрительной трубы спектроскопа образуется множество разноцветных изображений щели, примыкающих друг к другу и распределенных в соответствии с изменением длин волн, т. е. радужная полоска спектра. То направление, в котором вытянут спектр, называется направлением дисперсии. Понятно, почему щель спектроскопа должна быть достаточно узкой. Если мы расширим щель, то соседние монохроматические изображения належатся друг на друга и спектр «замоется».
При визуальных наблюдениях в спектроскоп мы видим радужную полоску спектра. Если же вместо окуляра поместить в фокальной плоскости зрительной трубы кассету, то зрительная труба превратится в фотографическую камеру, а спектроскоп в спектрограф - прибор, широко используемый астрофизиками. Правда, при его помощи получают черно-белое изображение спектра, но это нисколько не мешает получению богатейшей информации о небесных светилах.
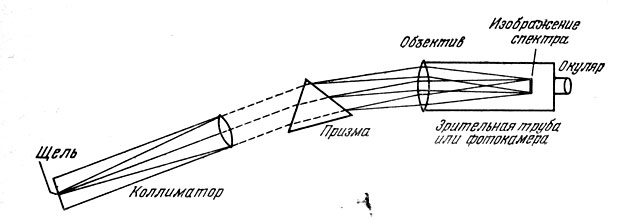
Рис. 73. Устройство спектроскопа
Спектр излучения, испускаемого накаленным твердым телом или нагретой до свечения жидкостью,- сплошной. Если посмотреть через спектроскоп на нить электрической лампочки, то можно увидеть яркую радужную полоску, которая называется непрерывным спектром. Существуют способы, которые дают возможность измерять интенсивность излучения в различных длинах волн. Тогда, отложив на горизонтальной оси длины волны Я, а на вертикальной оси - интенсивность излучения (энергию) Е\, получим график, который называется кривой распределения энергии в спектре (рис. 74). Вид этой кривой зависит главным образом от температуры излучателя. Для лучей, обладающих малой длиной волны, энергия Еλ мала. По мере увеличения длины волны энергия возрастает и при некоторой длине волны λмакс достигает максимума; при дальнейшем увеличении длины волны энергия излучения убывает. Оказывается, что температура Т и λ,макс связаны между собой формулой
Т х λМакс = постоянной величине.
Эта формула выражает закон Вина (В формулу входит абсолютная температура Г, отсчитываемая от температуры t = -273° по шкале Цельсия.) Из нее следует, что мало нагретые тела излучают длинноволновые (инфракрасные) лучи, в то время как сильно нагретые сильнее всего излучают синие и даже фиолетовые лучи. Изучая распределение энергии в спектре, можно определять температуру звезд. В этом состоит одна из задач, которые ставит перед собой астроспектроскопия.
Однако спектральные исследования дают возможность получать гораздо более богатую информацию о небесных светилах. Дело в том, что нагретый, доведенный до свечения разреженный газ излучает не непрерывный спектр, а линейчатый, состоящий из определенного набора узких, почти монохроматических спектральных линий. Яркие линии называются эмиссионными. Так, например, если ввести в пламя горелки обычную поваренную соль, то оно окрасится в интенсивный желтый цвет. В спектроскоп мы увидим две яркие желтые эмиссионные спектральные линии, обозначаемые D1 и D2, испускаемые нагретыми парами натрия, который входит в состав поваренной соли. Особенно богат линиями спектр железа, превращенного при высокой температуре в газообразное состояние.
Составлены подробные атласы и каталоги спектральных линий химических элементов, и это помогает производить спектральный анализ вещества, узнавать, какие химические элементы в нем присутствуют.
Надо иметь в виду, что помимо эмиссионных линий наблюдаются также абсорбционные, темные линии поглощения, которые занимают те же места в спектре. Их легко пронаблюдать в лаборатории, если проделать такой опыт. Наблюдая в спектроскоп непрерывный спектр накаленного твердого тела, поместим на пути лучей, между этим телом и щелью спектроскопа, пламя горелки, насыщенной парами натрия. На месте двух ярких желтых эмиссионных линий натрия мы увидим на фоне непрерывного спектра две темные линии D1 и D2, так как пары и газы способны поглощать те же самые излучения, которые они сами испускают.
Вид линейчатого спектра, длины волн спектральных линий зависят от свойств данного атома. Как известно, атом любого химического элемента состоит из центрального, положительно заряженного ядра, окруженного электронами. Наименее прочно связанный с ядром электрон легче поддается внешним воздействиям - его называют оптическим электроном. Этот электрон способен поглощать падающую на атом извне энергию излучения; «запасаясь» дополнительной энергией, он изменяет свое движение, приходя в возбужденное состояние. Он может также прийти в возбужденное состояние и в результате столкновений атома с другим атомом или электроном, которые неизбежны при тепловом движении.
Атомная физика установила, что у каждого атома существуют свои определенные дискретные энергетические уровни, и электрон, при своих переходах может «задерживаться» только на них. Каждому из уровней можно приписать определенный номер-главное квантовое число; чем выше расположен этот уровень, тем больше его энергия. Обозначим энергию, соответствующую квантовому числу k, через Еk, а квантовому числу i - через Еi и допустим, что Ek больше, чем Ei. Пусть, далее, оптический электрон возбужден до состояния Ek. По законам атомной физики электрон не может долго оставаться в возбужденном состоянии (за исключением некоторых уровней энергии) и через миллионные доли секунды самопроизвольно, как говорят, спонтанно, должен перейти в другое состояние, обладающее меньшей энергией.
Допустим, что он перешёл и состояние с энергией Еi. Этот переход сопровождается излучением фотона, энергия которого равна разности ек - ei. Фотон будет иметь частоту vfti, которая вычисляется по формуле
hνki = Ek - E i (3.5)
где h - постоянная Планка, равная 6,6 X 10-27 эрг' х сек. Фотон имеет не только частоту, но и длину волны λ = с : ν, где через с обозначена скорость света.
Таким образом, в результате этого перехода оптический электрон испустит дискретную спектральную линию, обладающую длиной волны λki. Так, из различных переходов оптического электрона образуется линейчатый эмиссионный спектр.
В нормальном, невозбужденном состоянии электрон обладает энергией самого глубокого уровня, которую мы обозначим через Е±. Теперь допустим, что на атом падает извне излучение самых разнообразных частот v. Может ли оптический электрон поглотить излучение любой частоты, т. е. любой длины волны? Конечно, нет, и вот почему.
У данного атома имеются следующие «дозволенные» уровни энергии, которые мы выписываем в порядке ее возрастания:
Е1,Е2,Е3,...Еi,...,Еk,...,Е∞
Электрон может поглощать излучения только тех частот, которые соответствуют переходам
Е2 - Е1 = hν21, Е3 - Е1 = hν 31, Е4 - Е1 = hν 41 и т. д.
Все эти переходы соответствуют дискретным спектральным линиям с длинами волн
λ21,λ31,λ41 и т.д.,
которые все вместе образуют серию спектральных линий, соответствующих поглощению излучения электроном при его переходе с одного и того же уровня энергии Е1.
Если перед тем, как поглотить энергию излучения, оптический электрон уже был возбужденным и находился, например, в состоянии с энергией E2, то он может поглощать порции энергии
Е3 - Е2 = hν32, Е4 - Е2 = hν42, Е5 - Е2 = hν52
т. е. опять набор дискретных частот (следовательно, дискретных длин волн), но на этот раз другой серии, у которой нижний уровень энергии Е2.
Обобщая сказанное, заметим, что серий спектральных линий у данного атома бесконечно много, так как они могут начинаться с любого из уровней энергии. На практике приходится встречаться только с небольшим числом серий, потому что по мере увеличения квантового числа, соответствующего наиболее низкой энергии уровня, определяющего данную серию, вся серия сдвигается в инфракрасную часть спектра тем дальше, чем больше «начальное» квантовое число данной серии.
Но не следует думать, что один атомов результате единичного акта поглощения энергии одним электроном может поглотить все доступные для него излучения соответствующих длин волн. В результате единичного акта поглощения образуется только одна спектральная линия. Однако если атомов много и они помещены в поле излучения, обладающего самыми разнообразными частотами, то в непрерывном спектре этого излучения появятся все линии поглощения, объединяемые описанными выше сериями. В то же время, излучение с промежуточными длинами волн поглощаться не может, и для него «облако» атомов прозрачно. Для того чтобы наглядно разобраться в систематике спектральных линий данного химического элемента, свойственные ему дозволенные уровни энергии располагаются в виде схемы. Такая схема для атомов водорода изображена на рис. 75. Чем больше запас энергии оптического электрона, тем выше расположен уровень. Поэтому переходы с нижних уровней на верхние соответ-ствуют актам поглощения, т. е. образованию абсорбционной линии (т. е. линии поглощения). При переходах же сверху вниз происходит излучение эмиссионной спектральной линии.
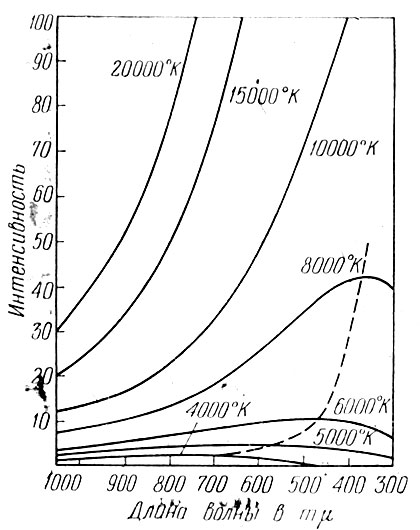
Рис. 74. Кривые распределения энергии в спектре раскаленного (абсолютно черного) тела разных при разных температурах. Интенсивности выражены в условных единицах
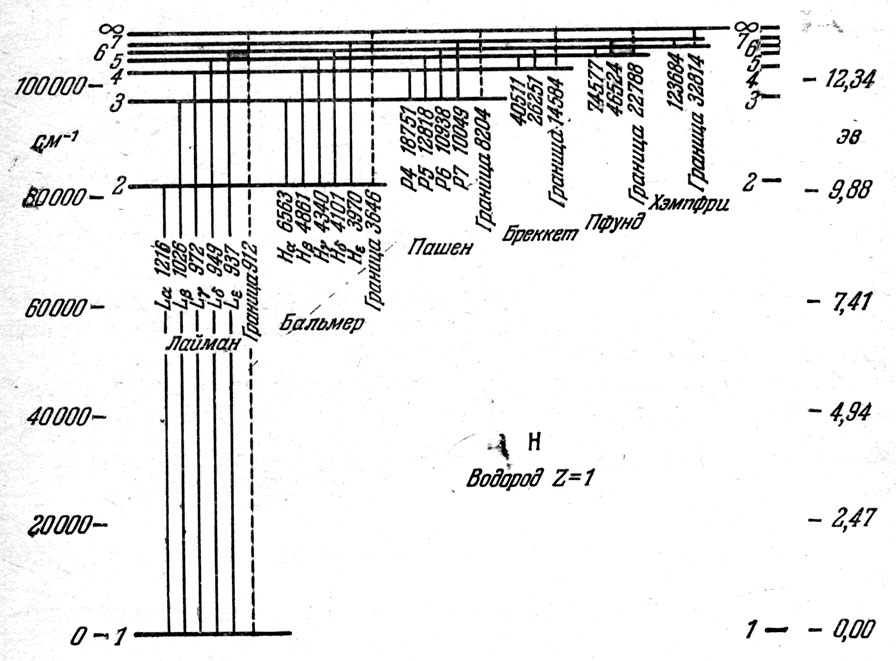
рис. 75. Энергетические уровни атома водорода: в правой части показаны потенциалы возбуждения, выраженные в электрон-вольтах, в левой - шкала волновых чисел. Около линий, изображающих переходы, написаны длины волн, в ангстремах
Слева от каждого уровня отмечены главные квантовые числа-номера уровней 1, 2, 3, 4, 5 и 6. Следующие, более высокие уровни надо нумеровать 7, 8, 9 и т. д. до бесконечности. При росте квантовых чисел уровни сближаются, и уровень энергии, помеченный знаком оо, соответствует бесконечно большому квантовому числу. Если электрон, находящийся в невозбужденном состоянии Е1, поглотит соответствующую этому уровню энергию, то он теряет связь с атомом и уходит от него в пространство, а атом ионизуется, приобретая при этом избыточный электрический заряд. Подсчитаем эту энергию и частоту поглощаемого излучения ν∞1. Тогда по формуле (3.5) hν∞1 = Е∞ - Е1. Частота ν∞1 называется частотой «головы» серии. Ей соответствует длина волны ν∞1.
Пусть теперь оптический электрон уже был возбужден до состояния Е2. Тогда для ионизации атома надо, чтобы электрон поглотил энергию
Е∞ - Е2 = hν∞2 ,
которой соответствуют частота ν∞2 и длина волны λ∞2. Это длина волны головы второй серии. Таким образом, каждая из серий имеет свою голову.
Но электрон может поглощать и большую энергию, т. е. еще более жесткое излучение, обладающее меньшей длиной волны.
Тогда он покинет атом с остаточной энергией 1/2 mυ2, которую можно вычислить по формуле
1/2 mυ2 = hν - (Е∞ - Еi) , (3.6)
где через Eiобозначена энергия того уровня, на котором находился электрон в момент поглощения фотона.
Таким образом, помимо линейчатого спектра, образуется и непрерывный.
Водород - один из наиболее распространенных во Вселенной химических элементов, и с его свойствами нам придется встретиться в дальнейшем не раз. Поэтому рассмотрим его несколько подробнее.
Находясь в нормальном состоянии Ег, оптический электрон может поглотить излучение, имеющее длину волны 1216 ангстрем (Ангстрем - единица длины, равная 10-8 см. Обозначается буквой А.). Образуется абсорбционная линия серии Лаймана, называемая линией Лайман-альфа (Lα). Электрон же переходит в возбужденное состояние, соответствующее уровню энергии Е2.
При поглощении энергии Е3 - Е1 электрон переходит на третий уровень: образуется линия, имеющая длину волны 1026 А и называемая линией Лайман-бета (Lβ). Ее длина волны меньше, чем у Lα. При переходе с первого уровня на четвертый поглощается спектральная линия Lγ, с длиной волны 973 А. Дальнейшие переходы из состояния Е1 приводят к появлению всей серии Лаймана, которая сгущается к своей голове с длиной волны 912 А. С этой длины во^ны в сторону более коротких волн вступает в свои права область непрерывного поглощения. При поглощении более жесткого излучения атом водорода ионизуется.
В земных условиях серия Лаймана в спектрах небесных светил наблюдаться не может, так как коротковолновый участок спектра с длинами волн меньшими 3200 А полностью поглощается земной атмосферой. Таким образом, серию Лаймана можно наблюдать в лабораториях или вне земной атмосферы со спутников и орбита-тальных обсерваторий. Это одна из задач внеатмосферной астрономии.
Переходы электрона со второго (возбужденного) уровня на более высокие порождают знаменитую серию Бальмера (рис. 76), которая не поглощается атмосферой. Ее хорошо видно в спектрах многих звезд.

Рис. 76. Четыре снимка спектров звезд с резко выраженными линиями серии Бальмера Hβ, Hγ, Hδ и Hε. Красный конец спектра справа, фиолетовый - слева
При переходе оптического электрона со второго уровня на третий образуется линия поглощения Нα, расположенная в красной области спектра. Линия поглощения Нр образуется при переходе электрона со второго уровня на четвертый; она обладает меньшей длиной волны, чем Нα. Далее следует Hγ, Нδ и т. д. Вся серия Бальмера сходится к своей голове, которая имеет длину волны, равную 3646 А. При более коротких длинах волн мы снова встречаем область непрерывного поглощения, приводящего к ионизации атома. На этот раз электрон покидает атом со второго уровня, из возбужденного состояния.
При переходах электрона с третьего уровня на высшие образуется серия спектральных линий Пашена - Бака, расположенная в инфракрасной области спектра.
До сих пор мы имели дело с атомарным спектром поглощения. Все сказанное можно применить и к эмиссионным спектрам излучения. Если электрон находится в верхнем возбужденном состоянии с энергией Ek, то он может, как мы говорили, испустить фотон частоты νki, возвращаясь на более низкий энергетический уровень Ei. В спектре появится яркая линия - эмиссионная. При этом часто возникает «размен» одного фотона на несколько, обладающих меньшими частотами. Приведем конкретный пример. Допустим, что в результате поглощения излучения оптический электрон атома водорода перешел с нормального уровня Е1 на уровень с энергией Е4. Это соответствует поглощению спектральной линии Lγ. После этого у возбужденного оптического электрона могут быть четыре возможности спонтанного перехода на уровни меньшей энергии:
1) переход с четвертого уровня на первый, при котором излучается та же спектральная линия Lγ;
2) переход с четвертого уровня на второй, а затем со второго -на первый; излучаются две спектральные линии Нβ и Lα;
3) переход с четвертого уровня на третий, а затем с третьего - на первый; излучаются две спектральные линии: Пашена - Бака α и Нβ;
4) переход с четвертого уровня на третий, далее с третьего -на второй, и затем со второго на первый; излучаются три спектральные линии Пашена - Бака α, Нα и Lα.
Такое явление наблюдается в космическом разреженном газе. Заметим, что при разделении одного фотона на несколько каждая из возникших спектральных линий имеет большую длину волны по сравнению с поглощенной.
Более детальное исследование атомных спектров и строения электронных оболочек атомов привело к выводу, что каждый энергетический уровень Ek, отвечающий главному квантовому числу k, состоит из нескольких подуровней. Они характеризуются, кроме главного квантового числа, еще побочными квантовыми числами и несколько отличаются друг от друга величиной энергии; теперь у них различные энергии, группирующиеся около Ek. По законам атомной физики не всякие переходы между подуровнями могут осуществляться, или, как говорят, разрешены. Бывают случаи, когда возбужденный оптический электрон после излучения разрешенной спектральной линии попадает на такой подуровень, из которого нет разрешенного выхода в сторону более глубоких уровней энергии, и он застревает в этом состоянии надолго. Тогда говорят, что электрон попал на сверхустойчивый, метастабильный уровень.
Однако законы атомной физики не знают абсолютных запрещений. Если переход из метастабильного уровня путем излучения запрещен, то это еще не означает, что он не может осуществиться. Дело в том, что время пребывания электрона на метастабильном уровне гораздо продолжительнее, чем на нормальном. Если за это время никакая внешняя причина (например, столкновение с другим атомом либо дополнительное поглощение фотона) не вы-ведет^электрон с метастабильного уровня, то он придет в нормальное состояние, испустив «запрещенную» спектральную линию.
Для осуществления такого перехода нужно, чтобы газ был очень разреженным и внешнее излучение было достаточно слабым. Это осуществляется, например, у планетарных туманностей и в солнечной короне.
У атома водорода самый глубокий уровень энергии Е1 состоит из двух подуровней, которые отличаются двумя возможными различными направлениями вращения электрона вокруг оси. Хотя эти уровни мало отличаются по энергии, один из них несколько выше и является метастабильным. Небольшая разность значений энергии приводит, в согласии с формулой (3.5), к тому, что в случае излучения запрещенной линии ее частота должна быть малой, а следовательно, длина волны - большой. Действительно, атом водорода, находясь в условиях космического пространства, излучает «радиолинию» с длиной волны, равной 21 см.
Теперь перейдем к описанию молекулярных спектров поглощения. Они состоят из более или менее широких полос, размещенных в характерных для данной молекулы участках спектра. Каждая из полос состоит из очень большого числа спектральных линий, столь тесно расположенных друг к другу, что их можно разделить только при помощи спектральных приборов, обладающих огромной дисперсией.
Молекулярные спектры хорошо изучены в земных лабораториях, и это дает возможность судить по виду спектра о химическом составе поглощающей свет среды, сквозь которую проходит излучение. Молекулы образуются и становятся устойчивыми при сравнительно низких температурах, например, в оболочках холодных (красных) звезд и в атмосферах планет.
Теперь надо упомянуть еще об одном явлении, на котором основаны многие важные выводы астрофизики. Речь идет о принципе Доплера, согласно которому при движении источника света вдоль луча зрения длины волн спектральных линий изменяются пропорционально скорости. Если нормальная (лабораторная) длина волны какой-либо спектральной линии равна А,0, а наблюдаемая длина волны λ, то справедлива формула
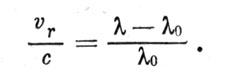
В ней через с обозначена скорость света, а через υr- лучевая скорость, равная проекции пространственной скорости на луч зрения. Если источник света удаляется, то длины волн увеличиваются, а если он приближается, то длины волн уменьшаются. Как нетрудно видеть из формулы (3. 7), у удаляющегося источника света лучевые скорости положительны, а у приближающегося -отрицательны.
До сих пор мы говорили главным образом о лабораторных исследованиях спектров. При изучении спектров небесных тел нужно учитывать некоторые особые условия.
Звезды, в том числе и Солнце,- огромные скопления газообразного, нагретого до высокой температуры вещества. В их внешних частях плотность и давление газа малы, но они быстро возрастают по мере углубления в недра. Быстро растет и температура. Достаточно сказать, что если во внешних слоях Солнца температура близка к шести тысячам градусов, то вблизи его центра она доходит до нескольких миллионов градусов. Скорость теплового движения газа здесь столь велика, что столкновения атомов приводят к их полной ионизации. Расчеты показывают, что такое вещество мало прозрачно для излучения. При подъеме в наружные слои непрозрачность уменьшается и, наконец, мы встречаемся с таким слоем, от которого к нам идет наблюдаемое нами излучение. Этот слой называется фотосферой.
Фотосфера испускает тепловое излучение, имеющее непрерывный спектр; оно возникает за счет хаотических тепловых движений заряженных частиц - электронов и ионов.
Над фотосферой расположены более разреженные и более холодные слои, в которых поглощается идущее от фотосферы излучение. Здесь образуется описанный выше спектр поглощения. Таким образом, изучая химический состав звезд по их спектрам, мы исследуем состав звездных атмосфер, но не звездных недр.
Точно так же, изучая дополнительные спектральные линии, возникающие в спектре той или иной планеты, по сравнению со спектром Солнца, мы изучаем химический состав ее атмосферы.
Кроме того, не надо забывать, что и земная атмосфера частично поглощает те или иные спектральные линии и полосы, которые называются теллурическими. Особенно сильно поглощение, производимое молекулами кислорода и водяными парами.
Доступны ли любителю астрономии исследования спектров небесных светил?
Конечно, многие задачи, такие, например, как определение лучевых скоростей, требующие применения очень сложного, мощного и дорогого оборудования, любитель решать не может. Вместе с тем некоторые спектральные наблюдения можно выполнять, пользуясь весьма скромными, подчас самодельными инструментами.
При помощи самого простого спектроскопа интересно и полезно познакомиться с видом солнечного спектра. Направив в щель спектроскопа рассеянный солнечный свет, мы увидим в окуляр радужную полоску спектра, пересеченную множеством темных линий поглощения (рис. 77). Некоторые из них обозначены буквами латинского алфавита. Их длины волн, выраженные в ангстремах, приведены в таблице II.
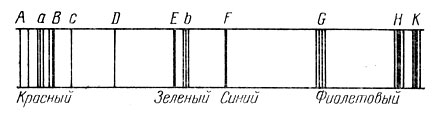
Рис. 77. Основные линии в спектре Солнца
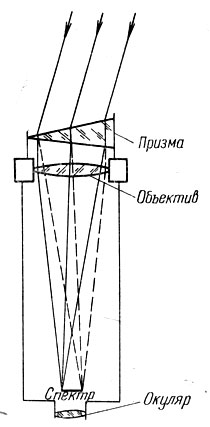
Рис. 78. Спектральная камера с объективной призмой
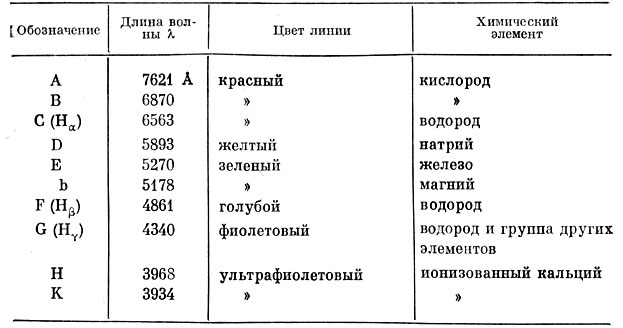
Таблица II. Наиболее заметные линии поглощения в спектре Солнца
Знание расположения этих линий может понадобиться при выполнении ряда практических работ (см. § 35).
Научные спектральные наблюдения любитель может выполнить, пользуясь объективной призмой. Помещенная перед объективом призма (рис. 78) разлагает идущий от звезды поток параллельных лучей на монохроматические пучки, по-разному отклоненные от первоначального направления, в зависимости от длины волны. В фокальной плоскости объектива образуется спектр. Так как каждый из монохроматических пучков дает точечное изображение звезды (если пренебречь остаточной хроматической аберрацией), то такой спектр имеет вид узкой нити, и рассмотреть в нем какие-либо подробности невозможно. Необходимо расширить спектр перпендикулярно к направлению дисперсии. Для этого надо установить в фокальной плоскости телескопа фотографическую пластинку, превратив его тем самым в спектрограф - призменную камеру. Если расположить преломляющее ребро призмы в направлении суточной параллели звездного неба, то, получая снимок неподвижной камерой, мы обнаружим на нем изображения растянутых суточным движением звездных спектров. Конечно, на таком нимке выйдут изображения спектров (спектрограммы) только самых ярких звезд. Призменная камера используется также при наблюдении спектров метеоров (см. § 62).
|
ПОИСК:
|
© 12APR.SU, 2010-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'