7.3. СРЕДСТВА ОБЕСПЕЧЕНИЯ ГАЗОВОГО СОСТАВА
Кислород в обитаемый объем может поступать как из имеющихся запасов, так и в результате его регенерации из продуктов жизнедеятельности.
Запасы кислорода могут быть в виде газа, хранящегося в баллонах при высоком давлении (самый простой способ хранения), в виде жидкости при криогенных температурах и относительно небольшом давлении, в связанном виде и т. п.
До давлений ~20 МПа изменение объема газа обратно пропорционально повышению давления и масса баллона остается практически неизменной.
Отношение массы запасов mз того или иного вещества к массе конструкции mк, которая обеспечивает их хранение, называют коэффициентом массы конструкции
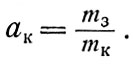
(7.1)
Для современных стальных баллонов ак=1,5 - 2,5, т. е. на 1 кг массы хранимого газообразного кислорода приходится 1,5 - 2,5 кг массы баллонов.
Меньшая масса (ак = 0,5) может быть получена при хранении кислорода в жидком состоянии при криогенных температурах и давлениях, близких к атмосферному. Так как получение в околоземном пространстве в результате внешнего теплообмена криогенных температур связано с определенными трудностями (см. раздел 6.3), баки с жидким кислородом тщательно теплоизолируют.
При отсутствии расхода тепло, прошедшее через изоляцию, увеличивает внутреннюю энергию хранимого кислорода, что приводит к повышению его температуры и давления. Если кислород из бака будет постоянно расходоваться, тепло пойдет на испарение уходящего в газообразном виде кислорода. Отбор газообразного кислорода из парожидкостной смеси в условиях невесомости требует довольно сложных устройств в баках хранения. На американских КК «Джемини» и «Аполлон» кислород хранился в однофазном надкритическом состоянии при температуре в начале полета 155 К и давлении 5 МПа. В процессе полета за счет теплопритоков температура увеличивалась, а давление при постоянном расходе кислорода оставалось примерно постоянным. Кислород использовался как для дыхания, так и для питания электрохимического генератора (ЭХГ). Такая система имеет ак = 1.
Кислород входит в состав многих химических соединений, но в качестве его источников пригодны только достаточно стабильные, легко его выделяющие (без посторонних примесей) соединения. Некоторые из них, содержащие кислород в достаточно больших количествах, используемые или предполагаемые для использования на борту КК, приведены в табл. 7.2.
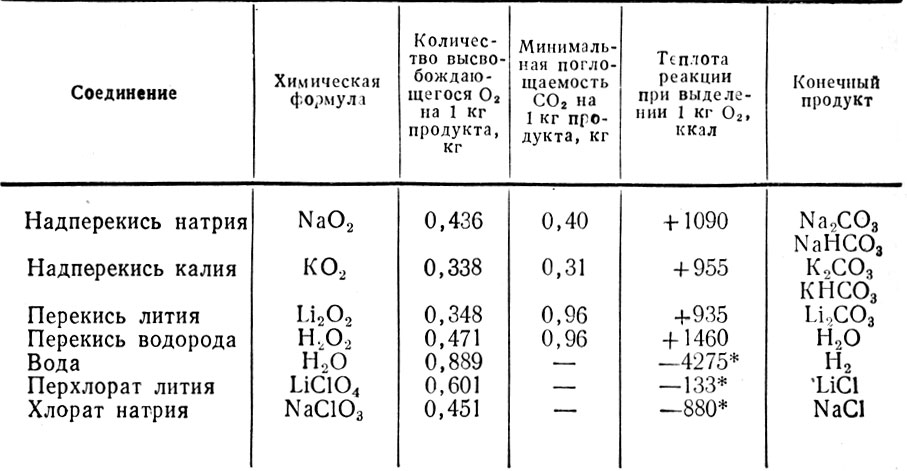
Таблица 7.2 Некоторые соединения, содержащие кислород
* (Эндотермическая реакция.)
Достоинством перекисных и надперекисных соединений щелочных металлов является то, что, будучи достаточно стойкими, они легко отдают кислород, а продукты реакции поглощают углекислый газ. Из этих соединений кислород выделяется в результате реакции вещества с парами воды, находящимися в атмосфере отсека:
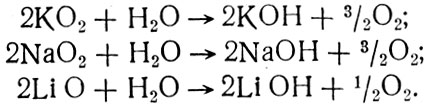
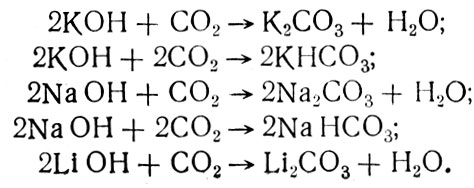
Получившиеся гидроокиси металлов реагируют с углекислым газом. Натрий и калий образуют в зависимости от условий реакции карбонаты и бикарбонаты:
Надперекиси и перекиси щелочных металлов использовались на КК «Восток», «Союз» и станциях «Салют».
Из хлората натрия кислород получают разложением его на хлористый натрий и кислород при температуре 973-1073 К:
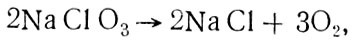
причем тепло для поддержания этой эндотермической реакции поступает за счет окисления небольшого количества порошка металла, смешанного с хлоратом, что приводит к некоторому уменьшению выхода кислорода.
Высококонцентрированная перекись водорода (99%) достаточно стабильное вещество при температуре 298 - 303 К, но при пропускании ее через катализатор разлагается на кислород и воду
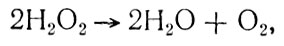
причем полученная в результате разложения вода пригодна для питья.
Перекись водорода используется полностью, а коэффициент
массы конструкции для ее запасов ак = 0,2.
Кислород из воды можно получить и в результате ее электролиза
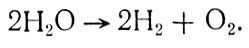
Так как для разложения 1 кг воды теоретически требуется 4,38 кВт-ч электроэнергии, а коэффициент массы конструкции aк≤0,2, этот метод перспективен для КА, имеющих мощные энергетические установки.
Кислород может быть получен и в результате регенерации его из углекислого газа с помощью реакции с водородом. Например, в зависимости от катализатора и условий, в которых происходит реакция, образуются или углерод и вода (реакция Боша при температуре 873 - 973 К) или метан и вода (реакция Сабатье при температуре 523 - 573 К). Метан после реакции Сабатье, подвергаясь пиролизу, разлагается на углерод и водород (реакция, начинаясь при 953 К, заканчивается при 1373 К).
Кислород выделяется в результате электролиза воды, а водород, полученный при разложении метана и воды, вновь взаимодействует с углекислым газом.
Теоретическое количество энергии, необходимое для получения 1 кг кислорода из углекислого газа, составляет 3,43 кВт-ч, хотя действительные затраты энергии, вероятно, будут составлять 10 - 15 кВт-ч, что связано с тепловыми потерями при проведении реакции при больших температурах и неоднократным разогревом и охлаждением веществ, участвующих в ней.
Необходимо подчеркнуть, что любые способы получения кислорода из углекислого газа достаточно сложны, ибо процессы проходят при высоких температурах и связаны с необходимостью отделения твердой фазы, что в условиях невесомости требует специальных сложных устройств.
Для очистки атмосферы обитаемых отсеков от углекислого газа применяют или связывание углекислого газа химическими веществами, или поглощение углекислого газа регенерируемыми поглотителями.
Поглощение углекислого газа надперекисными и перекисными соединениями щелочных металлов рассмотрено выше. Помимо них практически использовалась гидроокись лития, 1 кг которой способен поглотить 920 г углекислого газа:
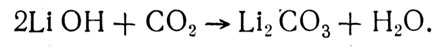
Гидроокись лития применялась в качестве поглотителя углекислого газа на американских КК «Меркурий», «Джемини» и «Аполлон».
При длительных полетах, когда источником кислорода служат вещества, неспособные поглощать углекислый газ после освобождения кислорода, целесообразно использовать системы поглощения углекислого газа на основе регенерируемых поглотителей (например, синтетических цеолитов). Поглощая углекислый газ при нормальных температуре и давлении, синтетические цеолиты способны восстанавливаться - отдавать углекислый газ в вакууме при нормальной температуре или при нагреве до 443 - 473 К при нормальном давлении.
Способность цеолитов отдавать углекислый газ при нагреве позволяет использовать их в качестве концентраторов углекислого газа с последующим его разложением в специальных аппаратах.
Помимо углекислого газа в атмосфере обитаемого объема всегда присутствуют вредные микропримеси, выделяемые как человеком, так и аппаратурой и материалами, особенно органическими. Основная масса микропримесей поглощается в фильтрах вредных примесей, основой которых, как правило, служит активированный уголь. Растворимые микропримеси частично поглощаются вместе с конденсатом атмосферной влаги в теплообменниках-конденсаторах. Основным средством борьбы с вредными примесями в атмосфере обитаемых отсеков является подбор материалов, не выделяющих вредные примеси.
|
ПОИСК:
|
© 12APR.SU, 2010-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'