2. Атом и его свойства
Расшифровка сведений, которые дают спектры, производится при помощи теории атома. Поэтому мы кратко напомним некоторые свойства атомов и их излучения.
Атом представляет собой систему из ядра и электронов, сдерживаемую электростатическим притяжением. Энергия атома (точнее, его электронной оболочки) может иметь только определенные значения, которые называются термами, или уровнями. Состояние с самой низкой энергией называется основным, остальные - возбужденными. Схема уровней энергии атома водорода показана на рис. 4, где каждая черточка изображает уровень (нижняя - основной). Расстояния уровней от основного пропорциональны энергии атома, отсчитываемой от энергии основного состояния.
Атом может изменять свою энергию, переходя из одного состояния в другое. Обычно это связано с изменением движения самого внешнего электрона. Переходы с более высоких уровней на более низкие могут происходить самопроизвольно, без внешнего воздействия, а разница энергии излучается с "порцией" светового излучения, называемой квантом. Частота излучаемого света пропорциональна энергии кванта. Поскольку различным переходам соответствуют строго определенные изменения энергии, атом излучает кванты лишь определенных частот, которые и дают отдельные линии в спектре. Переходы "вверх", т. е. с нижних уровней на верхние, самопроизвольно совершаться не могут; для их осуществления необходим внешний источник энергии (например, кванты соответствующей частоты). Такой процесс называется поглощением.
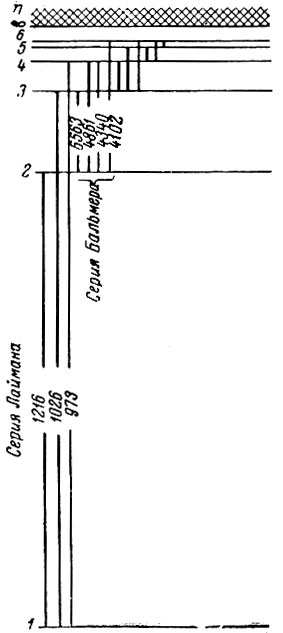
Рис. 4. Схема уровней атома водорода
Число уровней энергии атома бесконечно велико; они сгущаются у предела, который соответствует энергии, при которой электрон совсем отделяется от атома. Совокупность линий, образующихся при переходах на данный уровень со всех более высоких, называется спектральной серией. Так, у водорода имеется серия Лаймана, соответствующая переходам на первый уровень, серия Бальмера, образующаяся при переходах на второй уровень, и т. д. Поскольку первый уровень отстоит очень далеко от остальных, переходы на него сопровождаются большим изменением энергии, и кванты Лаймановской серии лежат в далекой ультрафиолетовой области. Например, линия Lα;, образующаяся при переходе со второго уровня на первый, имеет длину волны 1216Å1, тогда как фиолетовой части спектра соответствует длина волны около 4000 Å. Линии серии Бальмера - Нα (6563 Å), Нβ (4861 Å) и другие, лежат в видимой части спектра. Остальные серии водорода расположены в инфракрасной области. Уровни энергии других элементов более сложны. Чтобы представить их, нужно изобразить не одну колонку, как на рис. 4, а несколько, с общим верхним пределом.
1 (Å (ангстрем) - единица измерения длин волн в спектроскопии, равна 10-8 см.)
У большинства атомов энергетические уровни расщепляются на несколько близко расположенных подуровней. Поэтому линии часто состоят из двух или трех компонентов и более, вследствие чего они называются дублетами, триплетами и т. д. или в общем - мулътиплетами. Одиночные линии называются сингулетами. В сложных атомах расщепление уровней может быть очень сильным. Уровни атома водорода тоже состоят из двух подуровней, но энергии их практически одинаковы.
Сопоставляя спектр и схему уровней атома какого-либо элемента, можно заметить, что не всем переходам соответствуют наблюдаемые линии; некоторые переходы вообще не происходят. Такие переходы называются запрещенными. Разрешенныепереходы соответствуют строго определенным соотношениям между энергетическими уровнями, называемым правилами отбора. Следует отметить, что переходы, нарушающие правила отбора, не являются абсолютно запрещенными: при некоторых условиях соответствующие линии все же могут наблюдаться. "Степень" запрещенности лучше всего характеризовать тем временем, которое в среднем должно пройти, пока атом сможет" самопроизвольно совершить данный переход. Для разрешенного перехода это время составляет обычно 10-7 - 10-8 сек. Но чтобы совершить запрещенный переход, атом должен находиться в верхнем состоянии гораздо дольше - от 10-3 сек до нескольких суток и более, в зависимости от степени запрещения. Если с некоторого уровня нет разрешенных переходов "вниз", то атом при определенных условиях может находиться там сравнительно долго. Такие уровни называются метастабилъными. У большинства элементов и их ионов низкие уровни, близкие к основному, являются метастабильными.
Запрещенные линии обычно обозначаются символом элемента в квадратных скобках, причем римская цифра указывает степень ионизации. Например, [ОН] означает запрещенную линию ионизованного кислорода, a [OIII]- запрещенную линию дважды ионизованного кислорода. Для разрешенных линий квадратные скобки не ставятся.
Чтобы атом мог излучить квант, он должен оказаться на каком-либо из возбужденных уровней, т. е. ему нужно сообщить энергию, соответствующую разности энергий рассматриваемого уровня и исходного. Эта энергия может быть сообщена атому или при поглощении им кванта, или при столкновении его с другой частицей, главным образом с электроном. При этом энергия электрона должна быть больше энергии соответствующего перехода. Средняя энергия частиц пропорциональна абсолютной температуре газа. Однако даже если средняя энергия недостаточна для возбуждения, в газе всегда есть электроны с необходимой энергией, но число их быстро уменьшается с ростом энергии. Поэтому число возбуждений уровня, энергия которого заметно больше средней, будет относительно мало 1.
1 (Частота возбуждений зависит не только от числа электронов, энергия которых больше порога возбуждения, но и от свойств самого атома, точнее, от вероятности возбуждения данного уровня атома быстрым электроном.)
Удар иона или нейтрального атома также может перевести атом в возбужденное состояние, но для этого энергия иона должна быть в сотни или тысячи раз больше энергии уровня, потому что тяжелая частица, всегда передает легкому электрону атома только очень малую часть своей энергии. Поэтому возбуждение тяжелыми частицами обычно не имеет значения в астрофизических условиях, кроме тех случаев, когда энергия уровня исключительно мала.
Если электрон столкнется с возбужденным атомом, последний может передать ему свою энергию. Тогда атом перейдет в более низкое состояние без излучения кванта, а столкнувшийся электрон отскочит с увеличенной энергией. Такой процесс называется ударом второго рода, в отличие от процесса возбуждения атома при столкновении (удары первого рода). Удары второго рода существенны в плотных газах, где промежуток времени между столкновениями атомов меньше, чем время жизни атома в возбужденном состоянии. В этом случае атомы сталкиваются прежде чем успевают излучить, так что удары второго рода заметно ослабляют излучение. Для метастабильных уровней, с которых нет разрешенных переходов "вниз" и на которых поэтому атом находится значительно дольше, удары второго рода могут быть существенны и при низкой плотности. Именно поэтому мы не наблюдаем в лаборатории линий, соответствующих запрещенным переходам: возбуждение обычно заканчивается ударом второго рода, а не излучением. В очень разреженном газе интервал между столкновениями может стать сравнимым со временем существования в метастабильном состоянии, и запрещенные линии появятся. Как будет видно из дальнейшего, именно такие условия осуществляются в туманностях.
Если электрон приобретет большую энергию, чем предел термов, он оторвется от атома. Такой процесс называется ионизацией. Ионизация атома может произойти И при поглощении кванта, и при столкновении с быстрым электроном. Свободный электрон, не связанный с атомом, может иметь любую энергию. Поэтому, в отличие от переходов внутри атома, где могут поглощаться кванты только определенной частоты, ионизация может быть произведена любым квантом, энергия которого больше необходимой для перехода от исходного уровня к энергии ионизации. Например, атом водорода, находящийся на первом уровне, может поглотить любой квант, длина волны которого меньше 912 А, а со второго уровня - квант с длиной волны меньше 3646 А. Если энергия кванта больше, чем необходимо для отрыва электрона, то избыток энергии переходит в кинетическую энергию вырванного электрона. Ионизация ударом возможна только в случае, если энергия ударяющего электрона больше необходимой для отрыва. Чем выше температура газа, тем большее число электронов имеет необходимую энергию, тем чаще происходят ионизации и тем больше при прочих равных условиях доля ионизованных атомов. Тяжелая частица может ионизовать атом только при больших энергиях, значительно превышающих энергию ионизации.
Если газ имеет очень высокую температуру или находится в сильном поле излучения, то раньше чем он успеет поймать электрон обратно, от него может быть оторван второй, третий электрон и т. д. Так могут появиться многократно ионизованные атомы. Однако отрыв каждого следующего электрона требует все большей энергии, так как заряд иона возрастает. Поэтому для многократной ионизации нужна очень высокая температура газа или источника ионизующего излучения.
Процесс, обратный ионизации, называется рекомбинацией. Он представляет собой захват электрона ионом. Электрон может быть захвачен атомом на любой уровень. Поэтому атом, образовавшийся в результате рекомбинации, может быть как возбужденным, так и невозбужденным. При рекомбинации должна выделиться энергия, равная разности энергий свободного и связанного электрона, обычно в виде кванта. Если рекомбинирует электрон с малой энергией, то частота кванта близка к пределу серии соответствующего уровня. Чем больше энергия рекомбинирующего электрона, тем больше частота излучаемого кванта. Поскольку свободные электроны могут иметь любую энергию, спектр, излучаемый при рекомбинациях, имеет вид сплошной полосы, начинающейся сразу за пределом серии и тянущийся, постепенно ослабевая, в сторону больших частот. Такой спектр называется континуумом. Ослабление яркости вызвано тем, что доля быстрых электронов всегда падает с увеличением их энергии. Чем выше температура газа, тем больше средняя энергия рекомбинирующих электронов и тем медленнее спадает интенсивность за пределом серий.
Выше мы уже говорили, что атом способен излучать свет не только при рекомбинации, но и при переходах с одного энергетического уровня на другой. Оказывается, что и свободный электрон, двигаясь в электрическом поле иона, также способен испускать излучение.
Свободный электрон движется в поле иона по гиперболической орбите, причем разным энергиям соответствуют разные орбиты. Подобно тому как при переходе связанного в атоме электрона с одной эллиптической орбиты на другую излучается или поглощается квант, возможно излучение или поглощение кванта при переходе электрона с одной гиперболической орбиты на другую. Такой процесс называется свободно-свободным переходом. Поскольку энергия обеих орбит может иметь любые значения, излучение и поглощение при свободно-свободных переходах происходят в непрерывном спектре. Изменение энергии при свободно-свободных переходах обычно составляет небольшую долю полной энергии электрона, так что энергия излучаемых квантов меньше средней энергии электронов. При не очень высокой температуре свободно-свободное излучение газа сосредоточено в области длинных волн - от инфракрасных лучей до радиоволн.
До сих пор мы говорили об излучении и поглощении света отдельными атомами. В действительности же всегда наблюдается излучение целого слоя газа. Если слой газа прозрачен во всех частотах, излучение отдельных атомов будет просто суммироваться. Оно будет состоять из ярких линий на фоне менее яркого непрерывного спектра, образующегося при рекомбинациях на различные уровни и при свободно-свободных переходах. Но если увеличивать толщину слоя газа, то часть излучения будет им поглощаться. В первую очередь будут поглощаться кванты, образующие линии, и поэтому линии будут менее контрастны на фоне непрерывного спектра. Если однородный слой будет практически непрозрачен во всех частотах, то линии исчезнут. Излучение будет иметь непрерывный спектр, зависящий только от температуры, и максимум интенсивности в этом спектре будет смещаться в сторону коротких волн при возрастании температуры слоя газа. Одновременно будет увеличиваться общее количество энергии, излучаемой единицей поверхности. Излучение звезд усложнено тем, что слой не однороден - температура и плотность его растут с глубиной. Поэтому в спектре звезд имеются темные линии, и общий ход интенсивности в нем не совпадает со спектром непрозрачного слоя газа.
|
ПОИСК:
|
© 12APR.SU, 2010-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://12apr.su/ 'Библиотека по астрономии и космонавтике'